Dans une article paru il y a quelques années dans la publication « les nouvelles esthétiques », monsieur Hubert Djian, ingénieur chimiste, écrivait :
« Il est très difficile de rendre parfaitement compréhensible la notion pH aux lecteurs ne possédant pas un certain « bagage chimique ». Mais il est nécessaire qu’ils sachent tout au moins en quoi consiste cette notion. »
En utilisant l’article de l’auteur cité ci-dessus et différents autres textes nous allons nous efforcer de vous expliquer brièvement ce que signifient les expression :
- « pH »
- « prendre le pH »
- « mesure du pH »
- cette crème a un pH :
- acide
- alaclin
- neutre
Notion sur le « pH »
Les 2 lettres « pH » sont un symbole chimique.
Elles représentent l’abréviation de l’expression : « Puissance d’Hydrogène d’une solution ».
pH
Si vous demandez à un physicien ou à un chimiste de vous donner une définition moins « sibylline », il vous répondra probablement en ces termes : « le pH d’une solution aquese est le cologarithme de la concentration en ions Hydrogène de cette solution ».
De cette définition, remarquablement claire pour des « initiés », il vous suffira de retenir ceci :
- que le degré de concentration en ions hydrogène d’une solution détermine l’état d’acidité ou d’alcalinité ou de neutralité de cette solution
- qu’une solution est d’autant plus acide que sa concentration en ions hydrogène est plus élevée
Donnons quelques éclaircissements sur les termes :
- acide
- alcalin
- neutre
Acide
On appelle acide » un composé chimique qui fait passer au rouge la teinture bleue de tournesol et qui forme un sel lorsqu’on l’associe à une base ».
Un acide est caractérisé par sa saveur aigre, piquante : c’est l’acidité (acidité du citron de l’oseille…)
Alcalin
Ce terme chimique, qui est antonyme, c’est-à-dire l’opposé d’acidité, sert à définir une substance qui a les propriétés et la saveur des alcalis (soude, potasse, ammoniaque …)
Les alcalis ramènent au bleu les couleurs végétales rougies par un acide et, traités par les acides, donnent des sels.
Neutre
On appelle neutre, en langage « chimique », une solution qui n’est ni acide, ni alcaline.
La neutralité est donc l’état intermédiaire entre l’acidité et l’alcalinité.
Le chimiste mesure sa concentration en ions hydrogène, c’est-à-dire son pH pour connaître si un milieu déterminé (une lotion, ou un crème, par exemple) est :
- acide
- alcalin
- neutre
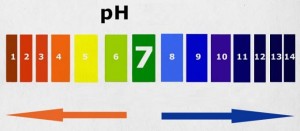
On représente le degré, l’état d’acidité, d’alcalinité ou des neutralité d’une solution par un indice de concentration de puissance (p), d’hydrogène (H) au moyen d’un « éventail » de valeur qui vont de 0 à 14.
Ces valeurs extrêmes se rencontrent très difficilement et correspondent à un état idéal qui échappe à la pratique.
- pH 0 – c’est un milieu où l’acidité est absolue, où elle atteint son maximum
- pH14 – c’est un milieux où l’alcalinité est absolue et où elle atteint son maximum
- pH7 est le milieu où l’acidité est analogue à celle de l’eau la plus pure ; pH7 représente le milieu neutre.
Tout ce qui est au-dessous de pH7 est acide ; tout ce qui est au-dessus de ce chiffre est alcalin.
Ainsi pH 8 signifie que le milieu est légèrement alcalin.
Quel intérêt de savoir le pH d’une solution ?
Selon Pozzi-Escot, « Toutes les réactions de la chimie sont déterminés par la nature du milieu au sein duquel elles sont réalisées. A ce point de vue, l’acidité ou l’alcalinité exerce une influence déterminante sur toutes les opérations analytiques ».
La chimie analytique, base de toute la chimie, n’est pas le seul domaine où il est capital de « prendre le pH ».

Chimiste
Cette mesure se révèle actuellement utile et souvent indispensable dans tous les domaines :
- en biologie
- dans les industries de la fermentation et du lait
- dans les industries alimentaires
- dans les industries de matières colorante
- même dans l’agriculture où la connaissance du pH du sol dirige la culture et le choix des engrais
Ajoutons à ces domaines, ceux qui nous intéressent plus spécialement, c’est-à-dire l’industrie cosmétique et les soins de beauté vise à embellir par exemple la coloration de la peau.
Posons-nous maintenant la question :
Quel intérêt a-t-on à connaître en biologie, en cosmétique et dans la pratique des soins esthétiques, si une solution, une substance, un milieu et même la peau sont :
- acides
- alcalins
- neutres
Raoul Hurlaux dit : « Dans quelque domaine que ce soit, si une réaction doit intervenir pour obtenir u résultat spécifique dans une fabrication, dans une culture, dans la préparation des vins, des colorants et, en particulier, des cosmétiques, il est indispensable de connaître la réaction chimique du milieu pour le modifier en vue d’un résultat spécifique, d’où la connaissance indispensable du pH ».
En biologie par exemple, la connaissance du pH est d’une importance extrême puisqu’il ne peut pas y avoir de vie possible (sauf cas tout à fait rares et sauf dans le milieu végétal), au-dessous de pH 4,5 et au-dessus de pH 8,5
Le pH du sang et des humeurs se situe aux environs de : 7,2
En dehors de ces limites, on assiste à des accidents extrêmement graves.
Les tissus ne peuvent vivre qu’entre deux indices relativement rapprochés l’un de l’autre fixés à pH 4,9 en acidose et pH 7,4 en alcalose.
On peut dire que « la vie a des affinités pour le milieu acide et tend à se détruire dans le milieu alcalin ».
L’alcalinité est donc anti-biologique.



